大学時代に調査した内容が論文として公開されたため、宣伝も兼ねてまとめていきます。 これまでの系統地理研究や遺伝的多様性調査に役立ててもらえるよう、試行錯誤しながら取り組みました。
本記事では、環境DNAを用いた遺伝的多様性評価法の現状について解説します。
1〜3章は導入なので、読み飛ばしていただいても構いません。
遺伝的多様性とは
遺伝的多様性とは、1つの生物種内に存在する遺伝子のバリエーションのことを指します。
遺伝的多様性は、生物が生存・適応するうえで重要な要素のひとつであり、「環境の多様性」「種の多様性」と並んで、生物多様性を構成する3要素に含まれています。これらが維持されることで、生態系のバランスが保たれています。
ただし、「遺伝子」という言葉は、1つのDNA領域全体を指す場合にも用いられるため、環境DNA分析の文脈では 1塩基多型(SNP: Single Nucleotide Polymorphism) を対象としていると考えてください。
以下の図のように、同じアユ個体群内であっても塩基配列には違いがあります。

アユ (Plecoglossus altivelis altivelis)のD-loop領域の一部分の種内変異
遺伝子のバリエーションは、私たちが日常的に意識することの少ない非常にミクロなスケールの話ですが、生物保全の観点からは極めて重要です。
同一種であっても、日本各地に分布する個体群は完全に同一(=クローン)ではありません。地理的距離が離れるにつれて、遺伝的な違いは大きくなる傾向があります。
この違いは、主に気候条件、地理的隔離、共存する生物相の違いなどに由来すると考えられます。こうした環境変化に柔軟に対応するためには、遺伝レベルでの多様性が不可欠です。言い換えれば、遺伝的多様性は進化と適応の原動力だと言えます。
遺伝的多様性を調査する意味
遺伝的多様性を調査することで、外見からは分からない集団の健全性を推定できます。
遺伝的多様性が高い集団は、病気や急激な環境変動に直面しても、集団全体が一度に壊滅する可能性は低くなります。一方で、遺伝的多様性が低下すると、集団全体が同じ病気に罹患したり、繁殖成功率が低下したりすることがあります。これは「近交弱勢」と呼ばれる現象です。
また、生態系には「ある閾値を超えると元に戻れなくなる」という性質が知られています。異常に気づいて人為的に介入し、多様性を回復させようとしても、すでに不可逆的な段階に入っている場合、その種は絶滅へと向かってしまう可能性があります。
このように、遺伝的多様性が不可逆的に失われる前にその実態を把握することは、生物保全において極めて重要です。
環境DNAを用いた遺伝的多様性研究
環境DNAは、捕獲が困難または禁止されている生物、あるいは広範囲を継続的にモニタリングしたい場合に特に有効な手法です。
魚類のモニタリング、分布調査、多様性調査といったキーワードが思い浮かんだ場合、環境DNAの活用を検討する価値があります。
大型脊椎動物を対象とした、環境DNAによる遺伝的多様性評価に関する主要な論文は以下の通りです。
2016年
Population characteristics of a large whale shark aggregation inferred from seawater environmental DNA 海水中の環境DNAから推定されるジンベイザメの個体群特性
Water, water everywhere: environmental DNA can unlock population structure in elusive marine species 全ての水から:環境DNAは海洋生物の個体群構造を明らかにすることができる
2019年
Population-level inferences from environmental DNA-Current status and future perspectives 環境DNAから個体群レベルの推定 - 近況と将来への期待
HaCeD-Seq: a Novel Method for Reliable and Easy Estimation About the Fish Population Using Haplotype Count from eDNA **HaCaD-Seq:環境DNAのハプロタイプ数を用いた魚類個体群の簡単で信頼できる革新的な推定方法
Evaluating intraspecific genetic diversity using environmental DNA and denoising approach: A case study using tank water 水槽水での実証研究: 環境DNAを用いた遺伝的多様性の評価とデノイジングアプローチ
2020年
Environmental DNA analysis shows high potential as a tool for estimating intraspecific genetic diversity in a wild fish population 環境DNA分析は魚類の野外個体群の遺伝的多様性を推定するためのツールとして高い可能性を示す
Quantitative evaluation of intraspecific genetic diversity in a natural fish population using environmental DNA analysis 自然個体群における環境DNAを用いた遺伝的多様性の定量的な評価法
これらの研究からも分かるように、環境DNAによるハプロタイプ推定で最も重要なのはデノイズ処理です。
1塩基の違いをハプロタイプとして扱うため、PCRエラーやシーケンスエラー由来のノイズを適切に除去しないと、結果は大きく歪みます。
水槽水での実証研究
水槽水での実証研究 : 環境DNAを用いた遺伝的多様性の評価とデノイジングアプローチ Evaluating intraspecific genetic diversity using environmental DNA and denoising approach: A case study using tank water
ざっくりとしたまとめは以下の通りです。
水槽実験において、飼育個体に由来する複数のアユmtDNAハプロタイプを環境DNA分析により同時に検出できたという内容。環境DNA分析を用いた遺伝的多様性検出における最大の問題点であるHTSデータ中のPCRやシーケンスエラーに由来する偽陽性ハプロタイプの99%を、「ASV法によるデノイズ処理+複数のPCR反復間における出現頻度に基づくデータ選択」という新しい解析アプローチにより排除し、検出精度を大幅に改善することに成功しました。
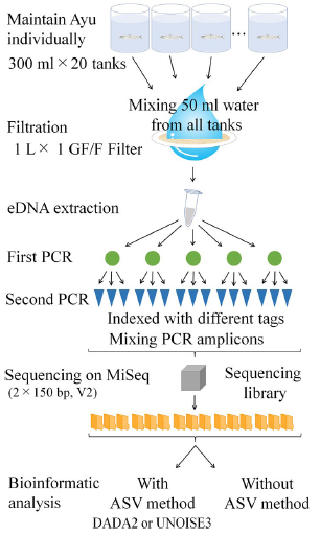
1st PCRを各サンプル5繰り返しで分析し、それぞれの繰り返しごとに2nd PCRを3繰り返し、1つの水槽から合計15繰り返しを生成しています。 飼育実験に使用した20個体のうち研究に用いたプライマー領域のハプロタイプ数は9ハプロタイプでした。
結果として、9の飼育個体由来のハプロタイプの他に検出されるはずのない5683のハプロタイプ(=偽陽性ハプロタイプ)が検出されました。
ここにDADA2とUNOISE3と呼ばれる、統計的にエラー配列を修正・除去するアルゴリズムを適用すると以下のようになります。
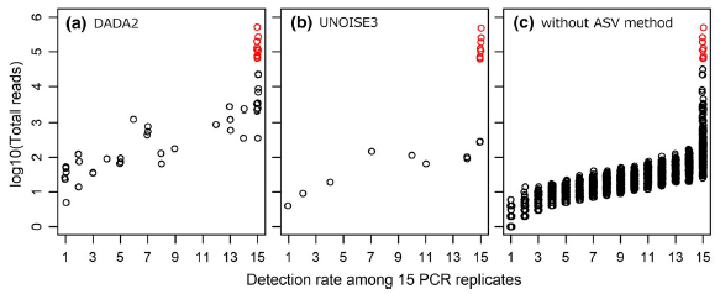
デノイジングアプローチを加えることにより、偽陽性と考えられるハプロタイプ(黒丸)が分かりやすく激減しています。また、正しいとされるハプロタイプは必ず15繰り返し全てで、どの偽陽性ハプロタイプのリードよりも多く検出されたそうです。
野外調査での実証研究
環境DNA分析は魚類の野外個体群の遺伝的多様性を推定するためのツールとして高い可能性を示す Environmental DNA analysis shows high potential as a tool for estimating intraspecific genetic diversity in a wild fish population
水槽実験で試料中に含まれる既知のハプロタイプを環境DNAで検出できるか検討したので、次は河川での捕獲調査と環境DNAでの結果を比較します。
オープンアクセスではないので、内容の公開は控えめにアブストベースで紹介していきます。
ざっくりとしたまとめは以下の通りです。
環境DNA分析を用いて野外アユ集団内の遺伝的多様性をどれだけちゃんと検出できるか?を捕獲調査の結果と比較することで検証した内容。結果として、環境DNA分析は大規模な捕獲調査(約100尾/地点)と同等、もしくはそれ以上の検出力を持つことが確認されました。捕獲調査のように、長い配列を使った解析はできませんが、多地点・高頻度で遺伝的多様性のモニタリングやスクリーニングをする際には、費用対効果・網羅性の面で環境DNA分析がうってつけの方法であると思います。
サンプリングは同日に河川から水試料(環境DNA用)と組織サンプル(サンガーシーケンスで分析用)を採取しています。
環境DNAは10Lの水試料を20枚のフィルターで均等な量でろ過して、それぞれを15回のPCR繰り返しで分析しました。組織サンプルは96個体のアユをサンガーシーケンスにて各個体の配列を決定しました。環境DNAの解析時のデノイズは水槽実験でも使っていたDADA2とUNOISE3を使用しています。
結果として、96個体のサンガーシーケンスから42ハプロタイプが検出されました。それらのハプロタイプのうち、環境DNAの水試料からUNOSE3では38ハプロタイプが、DADA2では41ハプロタイプが検出されました。また、DADA2をデノイズ法として用いた場合、1つのハプロタイプを除いて、少なくとも2/96個体以上が有するハプロタイプがすべてのフィルター反復から検出され、15回の繰り返しの検出確率が98%以上でした。
これらのことから、環境DNAを用いた遺伝的多様性調査の場合、500mLの水をろ過したGF/Fフィルター1枚から2/96個体しか保有しないようなかなり稀なハプロタイプまで検出できる可能性があるということが言えると思います。また、論文の実験のように1サンプルにつきフィルターを20枚を使用することは現実的ではなく、論文内では通常の遺伝的多様性調査で分析されるであろう個体数以上のハプロタイプが検出することが望めるPCRの反復数とフィルター数を考察したりもしています。(お水を500mL×複数すくって分析すればかなりの網羅性を望めます。。ごにょごにょ)
生態学研究への応用
自然個体群における環境DNAを用いた遺伝的多様性の定量的な評価法 Quantitative evaluation of intraspecific genetic diversity in a natural fish population using environmental DNA analysis. Molecular Ecology Resources.
上記の論文で、捕獲調査と比較してかなり稀なハプロタイプまで環境DNAで検出できることが分かりました。 また、Ushio et al.2018で定量的な環境DNAメタバーコーディング法が提案されているので、その原理を応用して”自然個体群における環境DNAを用いた遺伝的多様性の定量的な評価法”の検証をしました。
ざっくりとしたまとめは以下の通りです。
環境DNA分析を用いて、遺伝的多様性を量的に評価することが可能になりました。また、「どんなハプロタイプがあるか?」だけでなく、「各ハプロタイプがどれだけあるか?」を評価できるようになったことで、各ハプロタイプのコピー数を個体数の代用とし、塩基多様度や有効集団サイズの計算ができるようになったことを報告しています。これにより、新たに環境DNA分析の集団遺伝学や系統地理への利用の道が拓かれたと言えます。
端的に内容が示されているので、あまり追記することがありません。笑
まとめ
デノイズ法や実際の飼育環境と野外調査での検証により、環境DNA使ったハプロタイプ推定はかなり実用的なレベルまできていると思います。うまく使えば、今まで行われてきたような集団遺伝学や系統地理の一つの調査法になりえるかもしれません。
1杯の水から、どんなハプロタイプが出現するかを同地点で追っていくのも面白いと思いますし、定量的な評価を加えることで、集団構成の変化や場所による比較を様々な種で行うこともできるようになっていくのではないでしょうか。
※毎回解説の書き方が変わってますが、分かりやすい形を模索中です。ご了承ください。